
A partir do surto registrado em 2022, a mpox (anteriormente conhecida como monkeypox), uma doença zoonótica causada pelo vírus mpox (MPXV), transcendeu sua associação primária com a África Central e Ocidental, emergindo como uma notável preocupação de relevância global de saúde pública. Embora a maioria dos casos deste surto tenha sido observada entre adultos, o impacto da doença em crianças tem despertado crescente preocupação, principalmente devido à sua vulnerabilidade e ao potencial de complicações graves.
Neste contexto, destacamos neste documento o cenário atual da mpox com foco na população pediátrica, com base nas informações mais recentes até setembro de 2024, abordando aspectos clínicos, epidemiológicos, assim como seu manejo e prevenção
O vírus MPXV é um vírus de DNA, pertencente ao gênero Orthopoxvirus (o mesmo da varíola) da família Poxviridae (figuras 1 e 2), caracterizado por 2 clados geneticamente distintos: o Clado I (anteriormente conhecido como clado da Bacia do Congo), subdividido em subclados Ia e Ib e o Clado II (anteriormente conhecido como clado da África Ocidental), que se subdivide em subclados IIa e IIb. Diferenças genéticas entre os genomas virais dos dois clados podem explicar as diferenças na patogênese. O clado I tem sido, de forma geral, associado a taxas de letalidade mais altas (1,% a >10%) em comparação com o MPXV do clado II (0,1% a 3,6%). Entretanto, é nosso entendimento que devemos ser cautelosos em relação à conclusões a respeito das diferenças de gravidade entre estes clados, sendo necessários dados epidemiológicos mais robustos para determinar com clareza as diferenças potenciais entre os clados, em particular sobre o clado Ib recém-detectado.
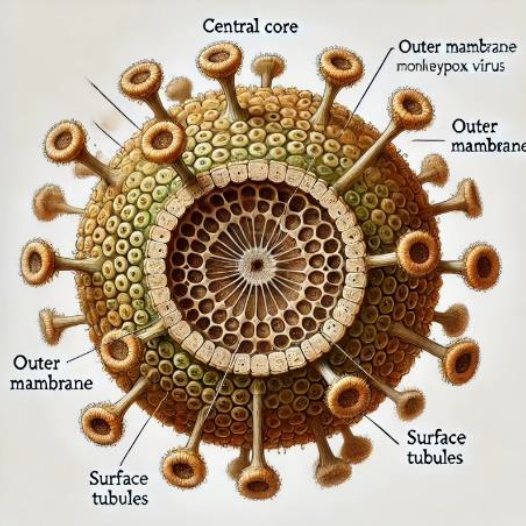
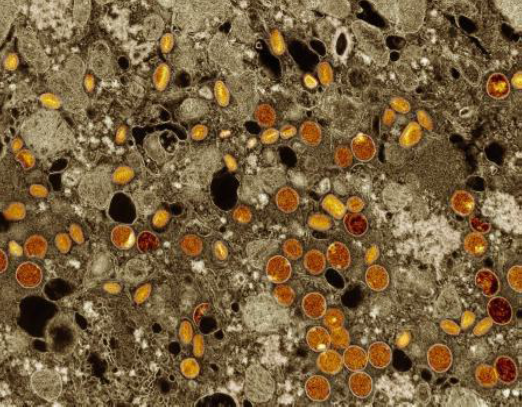
Figuras 1 e 2. 1.ilustração detalhada do MPXV com estruturas rotuladas, mostrando o núcleo central, membrana externa, filamentos internos, túbulos de superfície e corpos laterais. 2. Micrografia eletrônica de partículas do MPXV (vermelho/amarelo) encontradas nas células VERO E6 infectadas (marrom). As partículas do vírus estão em vários estágios de maturidade, o que explica as diferenças na forma (NIAID).
Desde 1970, a mpox tem sido endêmica em várias regiões da África, com surtos ocasionais exportados para outros continentes. O exemplo mais notável antes de 2022 foi o surto nos Estados Unidos em 2003, relacionado à importação de animais selvagens infectados.
Em maio de 2022, foi declarada uma Emergência de Saúde Pública de Importância Internacional após o aumento de casos de mpox em países sem histórico endêmico da doença. Esse surto afetou mais de 120 países com 106.310 casos confirmados globalmente até setembro de 2024, incluindo 234 mortes (Figura 3). O surto foi impulsionado principalmente pelo Clado IIb, acometendo majoritariamente homens que fazem sexo com homens, com mais da metade dos casos identificados em pessoas que viviam com HIV. Os 10 países mais afetados globalmente desde 1º de janeiro de 2022 são: Estados Unidos da América (n = 33.812), Brasil (n = 12.206), Espanha (n = 8.240), República Democrática do Congo (n = 6.092), França (n = 4.307), Colômbia (n = 4.262), México (n = 4.155), Reino Unido (n = 4.058), Peru (n = 3.939), e Alemanha (n = 3 909). Juntos, esses países respondem por 79,9% dos casos relatados globalmente.

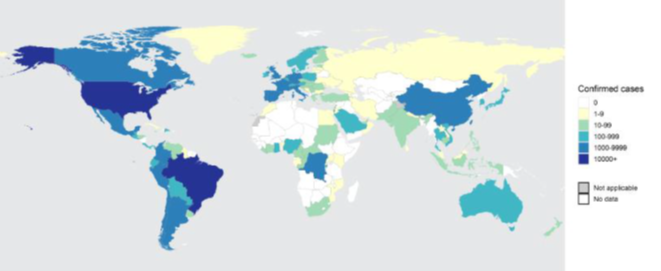
Figura 3. Casos de mpox reportados no mundo (janeiro de 2022 a 31 de agosto de 2024).
No Brasil entre a semana 1 e a semana 35 de 2024, foram confirmados 945 casos de mpox. Homens responderam por 94.8% dos casos (n= 897 cases) com 46.3% no grupo de 30-39 anos (N=415 casos). Apenas 12 casos foram reportados em crianças e adolescentes de até 18 anos de idade. Entre os 723 casos com informação disponível, 9,3% foram hospitalizados.
Em 2023, a combinação de campanhas de saúde pública, disponibilidade de vacinas e ações de comunidades impactadas levou a uma diminuição do registro de novos casos em todo o mundo, permitindo a suspensão da condição de emergência de saúde pública internacional. No entanto, em agosto de 2024, após identificação de novos surtos, agora associados aos clados Ia e Ib na República Democrática do Congo (RDC) e outros países africanos a OMS voltou a declarar emergência de saúde pública de preocupação internacional.
Os dados disponíveis até o momento mostram importantes diferenças nas características dos grupos populacionais atingidos e das formas de transmissão do atual surto associado ao clado I, em comparação ao surto global anterior. O Clado Ia tem se caracterizado por acometer principalmente crianças menores de 15 anos nas províncias endêmicas da RDC, com múltiplas formas de transmissão, que incluem exposição a animais, transmissão domiciliar e por contato sexual, enquanto o Clado Ib, que provavelmente emergiu em 2023, tem a transmissão sexual como principal forma de contágio, incluindo transmissão heterossexual, entre profissionais do sexo. O clado Ib está se espalhando no leste da RDC, afetando tanto crianças quanto adultos, e se expandindo para países africanos vizinhos, como Burundi, Quênia, Ruanda e Uganda (Figura 4). Todos os casos de mpox devido ao clado I do MPXV foram relatados em países africanos, exceto um caso relatado pela Suécia, em um viajante proveniente de uma área com registro de surto, sendo o Clado Ib confirmado neste caso e um pela Tailândia. Nenhuma transmissão secundária do clado I do MPXV foi relatada fora dos países africanos afetados.

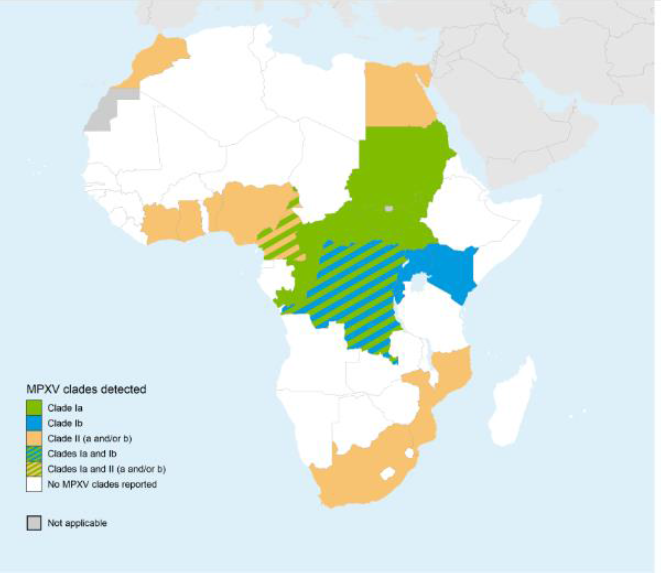
Figura 4. Clados de MPXV detectados na África (de janeiro de 2022 a 15 de setembro de 2024).
Historicamente, a mpox associada ao clado I apresenta taxas de letalidade maiores que aquelas observadas com o clado II, motivando um grau de preocupação de toda a comunidade científica com a atual situação. Relatos preliminares da RDC identificaram taxas de letalidade de 3,6% nos casos de mpox associados ao clado Ia. Para os casos associados ao clado Ib a informação ainda é limitada, mas a identificação de uma deleção em um gene, diminuindo sua virulência (deleção também presente no clado II) antecipa a provável menor letalidade associada ao clado Ib.
Há incertezas sobre a dinâmica de transmissão do mpox (Monkeypox) e seu impacto nas crianças. Os dados disponíveis sugerem que a carga da doença em crianças varia entre países e dentro deles, dependendo do clado do vírus que está circulando. A maioria das mortes de crianças por mpox ocorreu nas regiões Norte e Oeste da República Democrática do Congo (RDC), onde o clado Ia é predominante. Em contraste, não foram registradas mortes na região Leste da RDC ou nos países recentemente afetados, como Burundi, Ruanda, Quênia e Uganda, onde os surtos estão associados ao clado Ib. Quando há dados disponíveis, observa-se que bebês e crianças menores de cinco anos apresentam o maior risco de doença grave e morte, especialmente em locais onde o acesso a um atendimento de qualidade é limitado ou inexistente
O MPXV é transmitido entre humanos por meio do contato próximo com lesões, fluidos corporais, partículas respiratórias infecciosas ou fômites (por meio de roupas de cama, toalhas ou outros itens domésticos). Em áreas endêmicas, a transmissão também pode ocorrer de animais para humanos através do contato com animais vivos ou pelo consumo de carne de caça contaminada. Evidências clínicas sugerem a possibilidade de transmissão vertical da mpox durante a gravidez, podendo causar embriopatia e morte fetal.
A mpox causa sinais e sintomas que normalmente começam dentro de 3 a 7 dias após a exposição, podendo surgir já em 2 dias ou, em casos raros, até 21 dias após. Os sintomas geralmente duram de duas a quatro semanas, mas podem se prolongar em pessoas imunocomprometidas. Normalmente, febre, mialgia e odinofagia aparecem primeiro, seguidos por erupções cutâneas e lesões mucosas. A erupção cutânea caracteriza-se pela presença de lesões firmes ou elásticas, bem circunscritas, profundas e frequentemente umbilicadas em estágios posteriores. A erupção progride através de estágios maculares, papulares, vesiculares e pustulares antes de formar crostas e descamar (figura 5). A erupção pode ser localizada ou difusa, pode envolver as palmas das mãos e as solas dos pés, e pode se apresentar em diferentes áreas do corpo em momentos distintos. As lesões são frequentemente dolorosas ou pruriginosas. Cicatrizes com depressões e/ou áreas de pele mais clara ou mais escura podem permanecer após as crostas terem caído. Considera-se um indivíduo não transmissor somente quando todas as crostas tiverem caído e uma nova camada de pele se formado. A linfadenopatia também é uma característica típica da mpox, sendo frequentemente de localização cervical nas crianças. A transmissão por meio de contato sexual foi associada à ocorrência de lesões apenas na região genital em alguns casos. Crianças, mulheres grávidas e pessoas desnutridas ou imunocomprometidas têm maior risco de desenvolver complicações e morrer devido à mpox.

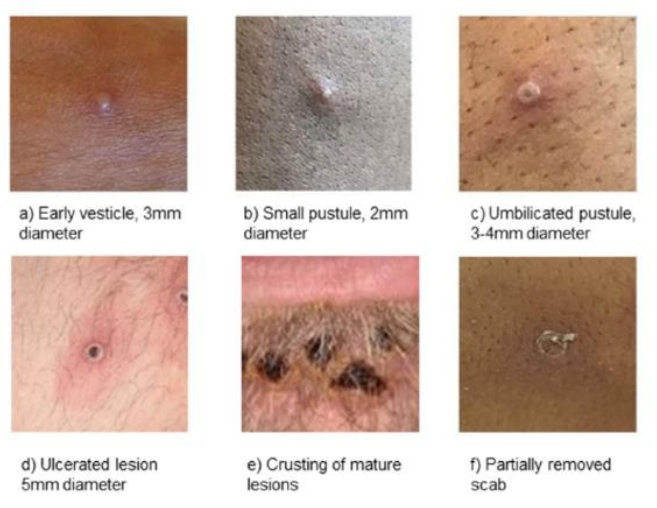

 Figura 5. Estágios das lesões do rash da mpox
Figura 5. Estágios das lesões do rash da mpox
É importante diferenciar a mpox de outras doenças, como varicela (catapora), sarampo, infecções bacterianas da pele, escabiose, herpes, sífilis, outras infecções sexualmente transmissíveis e alergias relacionadas a medicamentos.
Testes laboratoriais são importantes para confirmar a mpox, especialmente nos primeiros casos de um surto ou em uma nova área geográfica. O principal teste de diagnóstico para a infecção pelo MPXV é a reação em cadeia da polimerase (PCR). As melhores amostras para diagnóstico são coletadas diretamente da erupção cutânea – pele, fluido ou crostas – por meio de swabs vigorosos. Na ausência de lesões cutâneas, o teste pode ser realizado com swabs orofaríngeos, anais ou retais. No entanto, a sensibilidade na detecção do MPXV nestes locais é limitada. A realização de testes no sangue não é recomendada, pois a viremia é de forma geral fugaz. A sorologia não consegue diferenciar com acurácia os diferentes ortopoxvírus e, portanto, é restrita a laboratórios de referência. Após a identificação da nova sublinhagem do Clado I do MPXV (Clado Ib) e a observação de uma deleção que afeta os ensaios de tipagem comumente utilizados, foram desenvolvidos e validados novos ensaios de PCR em tempo real específicos para o Clado Ib, permitindo a rápida classificação do subclado em relação a outras cepas do Clado I e ao MPXV do Clado IIb que circula globalmente.
O tratamento é baseado principalmente no manejo dos sintomas clínicos, garantindo cuidados com a pele, alívio da dor e prevenção e controle de complicações. Embora não existam medicamentos aprovados especificamente para a mpox, medicamentos em investigação podem ser considerados para crianças e adolescentes com doença grave ou aqueles em maior risco de doença severa. O tecovirimat é o tratamento antiviral de primeira linha sendo utilizado sob um protocolo de Acesso Expandido a Medicamentos em Investigação. Atualmente, não há terapia aprovada especificamente para a varíola dos macacos. Vários ensaios estão em andamento para avaliar a eficácia e a segurança do tecovirimat em pacientes com clados I e II, mas os resultados preliminares sugerem pouco ou nenhum efeito no desfecho primário destes estudos.
A vacinação contra a varíola, que foi descontinuada após a erradicação da doença em 1980, confere proteção cruzada significativa contra a mpox, dado que ambas as doenças são causadas por vírus do gênero Orthopoxvirus. Estudos de vigilância na RDC mostraram que pessoas vacinadas contra a varíola antes de 1980 tiveram um risco 5,2 vezes menor de contrair mpox, com uma efetividade estimada de 80,7%. Outro estudo de vigilância também realizado na RDC sugeriu que uma vacina de primeira geração contra a varíola foi 85% eficaz na prevenção da mpox. Esses estudos forneceram evidências iniciais de que a vacinação contra a varíola também fornece proteção cruzada contra a mpox.
Atualmente, três vacinas podem ser consideradas para a prevenção da mpox: MVA-BN, LC16 e ACAM2000. Além disso, estudos e desenvolvimentos de vacinas de quarta geração, como VacΔ6 e vacinas à base de mRNA (BNT166a e BNT166), estão em andamento, com resultados promissores antecipando perspectivas de otimização no uso de vacinas para prevenção da mpox. As características e indicações específicas destas vacinas as tornam adequadas para diferentes cenários e populações de risco:
Embora a infecção prévia com mpox possa oferecer alguma proteção contra casos subsequentes, dados globais indicam que essa proteção não é completa. Casos de reinfecção foram documentados, embora os reinfectados geralmente apresentem quadros menos graves.
Vacinas contra a mpox também têm sido avaliadas no contexto pediátrico. Um estudo recente na Inglaterra avaliou a segurança e a resposta imune da vacina MVA-BN em 87 crianças durante um surto de mpox. Os resultados mostraram que a vacina foi bem tolerada, sem eventos adversos graves, e gerou uma resposta imune humoral eficaz, oferecendo proteção potencial contra a doença.
O atual surto de mpox, embora pareça associado a um baixo risco de expansão em países fora da África, como o Brasil, continua a representar uma ameaça significativa. Apesar das diferenças na epidemiologia das infecções pelos clados I e II da mpox, ambos podem infectar crianças e adolescentes e têm o potencial de causar morbidade e mortalidade significativas, incluindo hospitalização, perda de visão, doença grave e morte. Durante o surto de 2022, vacinas e medicamentos antivirais começaram a ser amplamente utilizados pela primeira vez para prevenir e tratar a mpox, mas ainda com limitadas informações sobre sua eficácia e segurança em pacientes pediátricos. A implementação de estratégias de prevenção, como a vacinação e a profilaxia pós-exposição, aliada a uma comunicação eficaz, são essenciais para mitigar os impactos da doença. A vigilância contínua em relação ao comportamento clínico da mpox em crianças e o desenvolvimento de terapias seguras e eficazes continuarão sendo cruciais para proteger esse grupo de risco.
Referências Bibliográficas